La física nuclear es una rama de la física moderna que estudia las propiedades y el comportamiento de los núcleos atómicos. La física nuclear es conocida mayoritariamente por la sociedad en su papel en la energía nuclear en centrales nucleares y en el desarrollo de armas nucleares, tanto de fisión como de fusión nuclear. En un contexto más amplio, se define la física nuclear y física de partículas como la rama de la física que estudia la estructura fundamental de la materia y las interacciones entre las partículas subatómicas.
Primeros experimentos
La radiactividad fue descubierta en las sales de uranio por el físico francés Henri Becquerel en 1896.
En 1898, los científicos Marie y Pierre Curie descubrieron dos elementos radiactivos existentes en la naturaleza, el polonio (84Po) y el radio (88Ra).
En 1913 Niels Bohr publica su modelo de átomo, consistente en un núcleo central compuesto por partículas que concentran la práctica mayoría de la masa del átomo (neutrones y protones), rodeado por varias capas de partículas cargadas casi sin masa (electrones). Mientras que el tamaño del átomo resulta ser del orden del angstrom (10-10 m), el núcleo puede medirse en fermis (10-15 m), o sea, el núcleo es 100.000 veces menor que el átomo.
Ernest Rutherford en el año 1918 definió la existencia de los núcleos de hidrógeno. Rutherford sugirió que el núcleo de hidrógeno, cuyo número atómico se sabía que era 1, debía ser una partícula fundamental. Se adoptó para esta nueva partícula el nombre de protón sugerido en 1886 por Goldstein para definir ciertas partículas que aparecían en los tubos catódicos.
Durante la década de 1930, Irène y Jean Frédéric Joliot-Curie obtuvieron los primeros nucleidos radiactivos artificiales bombardeando boro (5B) y aluminio (13Al) con partículas α para formar isótopos radiactivos de nitrógeno (7N) y fósforo (15P). Algunos isótopos de estos elementos presentes en la naturaleza son estables. Los isótopos inestables se encuentran en proporciones muy bajas.
En 1932 James Chadwick realizó una serie de experimentos con una radiactividad especial que definió en términos de corpúsculos, o partículas que formaban esa radiación. Esta nueva radiación no tenía carga eléctrica y poseía una masa casi idéntica a la del protón. Inicialmente se postuló que fuera resultado de la unión de un protón y un electrón formando una especie de dipolo eléctrico. Posteriores experimentos descartaron esta idea llegando a la conclusión de que era una nueva partícula procedente del núcleo a la que se llamó neutrones.
Los científicos alemanes Otto Hahn y Fritz Strassmann descubrieron la fisión nuclear en 1938. Cuando se irradia uranio con neutrones, algunos núcleos se dividen en dos núcleos con números atómicos. La fisión libera una cantidad enorme de energía y se utiliza en armas y reactores de fisión nuclear.
Reacciones nucleares
Colisión inelástica
La física nuclear incluye también el estudio de las reacciones nucleares: el uso de proyectiles nucleares para convertir un tipo de núcleo en otro. Si, por ejemplo, se bombardea el sodio con neutrones, parte de los núcleos estables Na capturan estos neutrones para formar núcleos radiactivos ²Na:
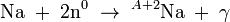
Estas reacciones se estudian colocando muestras dentro de los reactores nucleares para producir un flujo alto de neutrones (número elevado de neutrones por unidad de área).
Los núcleos también pueden reaccionar entre ellos pero, si están cargados positivamente, se repelen entre sí con gran fuerza. Los núcleos proyectiles deben tener una energía lo bastante alta como para superar la repulsión y reaccionar con los núcleos blanco. Los núcleos de alta energía se obtienen en los ciclotrones, en los generadores de Van de Graaff y en otros aceleradores de partículas.
Una reacción nuclear típica es la que se utilizó para producir artificialmente el elemento siguiente al uranio (238U), que es el elemento más pesado existente en la naturaleza. El neptunio (Np) se obtuvo bombardeando uranio con deuterones (núcleos del isótopo hidrógeno pesado, 2H) según la reacción:

Colisión elástica
Desintegración nuclear
Los núcleos atómicos consisten en protones, cargados positivamente y neutrones sin carga. El número de protones de un núcleo es su número atómico, que define al elemento químico. Todos los núcleos con 11 protones, por ejemplo, son núcleos de átomos de sodio (Na). Un elemento puede tener varios isótopos, cuyos núcleos tienen un número distinto de neutrones. Por ejemplo, el núcleo de sodio estable contiene 12 neutrones, mientras que los que contienen 13 neutrones son radiactivos. Esos isótopos se anotan como  y
y 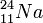 , donde el subíndice indica el número atómico, y el superíndice representa el número total de nucleones, es decir, de neutrones y protones. A cualquier especie de núcleo designada por un cierto número atómico y de neutrones se le llama nucleido.
, donde el subíndice indica el número atómico, y el superíndice representa el número total de nucleones, es decir, de neutrones y protones. A cualquier especie de núcleo designada por un cierto número atómico y de neutrones se le llama nucleido.
Los nucleidos radiactivos son inestables y sufren una transformación espontánea en nucleidos de otros elementos, liberando energía en el proceso (véase Radiactividad).
Esas transformaciones incluyen la desintegración alfa, que supone la emisión de un núcleo de helio ( ), y la desintegración beta (que puede ser β- o β+). En la desintegración β- un neutrón se transforma en un protón con la emisión simultánea de un electrón de alta energía y un antineutrino electrónico. En la desintegración β+ un protón se convierte en un neutrón emitiendo un positrón.
), y la desintegración beta (que puede ser β- o β+). En la desintegración β- un neutrón se transforma en un protón con la emisión simultánea de un electrón de alta energía y un antineutrino electrónico. En la desintegración β+ un protón se convierte en un neutrón emitiendo un positrón.
Por ejemplo, el 24Na sufre una desintegración β- formando el elemento superior, el magnesio:

La radiación gamma es radiación electromagnética de alta frecuencia (y por tanto energía). Cuando se produce la desintegración α o β, el núcleo resultante permanece a menudo en un estado excitado (de mayor energía), por lo que posteriormente se produce la desexcitación emitiendo rayos gamma.
Al representar la desintegración de un nucleido radiactivo se debe determinar también el periodo de semidesintegración del nucleido. El periodo de semidesintegración del 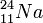 , es de 15 horas. Es importante determinar el tipo y energía de la radiación emitida por el nucleido.
, es de 15 horas. Es importante determinar el tipo y energía de la radiación emitida por el nucleido.
Fisión
Los conceptos de fisión y fusión nuclear difieren en las características de formación de cada uno. De esta forma se encuentra que la fisión (utilizada en las bombas y reactores nucleares) consiste en el "bombardeo" de partículas subatómicas al uranio (o a cualquier elemento transuránico, siempre y cuando sus características lo permitan), trayendo como consecuencia la fisión (de allí su nombre) del átomo y con esto la de los demás átomos adyacentes al bombardeado en reacción en cadena. Mientras que, la fusión es la unión bajo ciertas condiciones (altas presiones, altas temperaturas, altas cargas, etc.) de dos o más átomos y genera mucha más energía que la fisión.
Fusión
La fusión representa diversos problemas, ya que a nivel atómico las cargas de los átomos se repelen entre sí impidiendo la unión de estos, por esto se recurre generalmente a la utilización de isotópos ligeros, con menor carga eléctrica (como el hidrógeno y sus isótopos deuterio y tritio). En ciertas condiciones, definidas por los criterios de Lawson, se lograría la fusión de dichos átomos. Para ello primero se les debe convertir al estado de plasma, ionizándolos, favoreciendo a la unión. Esto se consigue mediante dos métodos básicos: el confinamiento magnético y el confinamiento inercial. Existen varias posibilidades para producir la fusión a partir de los isótopos del hidrógeno.
La energía de la fusión aun no se ha podido aprovechar con fines prácticos.
Representa algunas ventajas en relación a la fisión nuclear:
- Produce menos residuos nucleares.
- En los diseños actuales se necesita un aporte exterior de energía para que la reacción en cadena se mantenga.
- Produce más energía por reacción.
También posee desventajas:
- La reacción más energética es deuterio+tritio, y el tritio es un elemento muy escaso en la Tierra.
- Las condiciones necesarias son tan extremas que solo se dan en el centro de las estrellas, por lo que son muy difíciles de alcanzar y controlar.
Las técnicas conocidas de alcanzar las condiciones impuestas por los criterios de Lawson son dos:
Detección
Análisis radioquímico como apoyo a la detección
Las partículas alfa, que son emitidas normalmente por elementos con números atómicos superiores a 83, tienen la energía discreta característica de los nucleidos emisores. Así, los emisores α pueden ser identificados midiendo la energía de las partículas α. Las muestras a medir deben ser muy delgadas porque estas partículas pierden rápidamente energía al atravesar el material. Los rayos gamma también tienen la energía discreta característica del nucleido que se desintegra, por lo que la energía de estos rayos también puede usarse para identificar nucleidos. Puesto que los rayos gamma pueden atravesar una cantidad considerable de material sin perder energía, la muestra no tiene que ser delgada. Los espectros de energía de las partículas beta (y los positrones) no son útiles para identificar nucleidos porque se extienden sobre todas las energías hasta un máximo para cada emisor β.
Análisis mediante activación neutrónica
Con frecuencia, las técnicas de física nuclear se emplean para analizar materiales rastreando elementos presentes en cantidades muy pequeñas. La técnica utilizada se llama análisis de activación. Se irradia una muestra con proyectiles nucleares (normalmente neutrones) para convertir nucleidos estables en nucleidos radiactivos, que luego se miden con detectores de radiación nuclear. Por ejemplo, el sodio de una muestra puede ser detectado irradiando la muestra con neutrones, y convirtiendo así parte de los núcleos estables ®Na en núcleos radiactivos ²Na; a continuación se mide la cantidad de estos últimos contando las partículas β y los rayos g emitidos.
El análisis de activación puede medir (sin separación química) cantidades tan pequeñas como 1 nanogramo (10-9 g) de unos 35 elementos en materiales como el suelo, las rocas, los meteoritos y las muestras lunares. También puede utilizarse para analizar muestras biológicas, como la sangre y el tejido humano; sin embargo, en los materiales biológicos se pueden observar pocos elementos sin separaciones químicas.
Otras aplicaciones importantes de la física nuclear son el desarrollo de métodos para producir especies radiactivas utilizadas para la diagnosis y los tratamientos médicos. También ha desarrollado los isótopos trazadores que se usan para estudiar el comportamiento químico de los elementos, para medir el desgaste de los motores de automóviles y en otros estudios que emplean cantidades mínimas de material.
Radiactividad
La radiactividad o radioactividad es un fenómeno físico natural, por el cual algunos cuerpos o elementos químicos llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas fotográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, etc. Debido a esa capacidad se les suele denominar radiaciones ionizantes (en contraste con las no ionizantes). Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de Helio, electrones o positrones, protones u otras.
La radiactividad es una propiedad de los isótopos que son "inestables". Es decir que se mantienen en un estado excitado en sus capas electrónicas o nucleares, con lo que para alcanzar su estado fundamental deben perder energía. Lo hacen en emisiones electromagnéticas o en emisiones de partículas con una determinada energía cinética. Esto se produce variando la energía de sus electrones (emitiendo rayos X), sus nucleones (rayo gamma) o variando el isótopo (al emitir desde el núcleo electrones, positrones, neutrones, protones o partículas más pesadas), y en varios pasos sucesivos, con lo que un isótopo pesado puede terminar convirtiéndose en uno mucho más ligero, como el Uranio que con el transcurrir de los siglos acaba convirtiéndose en plomo.
Es aprovechada para la obtención de energía, usada en medicina (radioterapia y radiodiagnóstico) y en aplicaciones industriales (medidas de espesores y densidades entre otras).
La radiactividad puede ser:
- Natural: manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: manifestada por los radioisótopos producidos en transformaciones artificiales.
Radiactividad natural
En 1896 Becquerel descubrió que ciertas sales de uranio emitían radiaciones espontáneamente, al observar que velaban las placas fotográficas envueltas en papel negro. Hizo ensayos con el mineral en caliente, en frío, pulverizado, disuelto en ácidos y la intensidad de la misteriosa radiación era siempre la misma. Por tanto, esta nueva propiedad de la materia, que recibió el nombre de radiactividad, no dependía de la forma física o química en la que se encontraban los átomos del cuerpo radiactivo, sino que era una propiedad que radicaba en el interior mismo del átomo.
El estudio del nuevo fenómeno y su desarrollo posterior se debe casi exclusivamente al matrimonio Curie, quienes encontraron otras sustancias radiactivas como el torio, polonio y radio. La intensidad de la radiación emitida era proporcional a la cantidad de uranio presente, por lo que dedujo Marie Curie que la radiactividad era una propiedad atómica. El fenómeno de la radiactividad se origina exclusivamente en el núcleo de los átomos radiactivos. Se cree que la causa que lo origina es debida a la interacción neutrón-protón del mismo. Al estudiar la radiación emitida por el radio se comprobó que era compleja, pues al aplicarle un campo magnético parte de ella se desviaba de su trayectoria y otra parte no.
Pronto se vio que todas estas reacciones provenían del núcleo atómico que describió Rutherford en 1911, quien también demostró que las radiaciones emitidas por las sales de uranio eran capaces de ionizar el aire y de producir la descarga de cuerpos cargados eléctricamente.
Con el uso del neutrino, partícula descrita en 1930 por Pauli pero no medida hasta 1956 por Clyde Cowan y sus colaboradores, consiguió describirse la radiación beta.
En 1932 James Chadwick descubrió la existencia del neutrón que Wolfgang Pauli había predicho en 1930, e inmediatamente después Enrico Fermi descubrió que ciertas radiaciones emitidas en fenómenos no muy comunes de desintegración eran en realidad neutrones.
Radiactividad artificial

Símbolo utilizado tradicionalmente para indicar la presencia de radiactividad
Se produce la radiactividad inducida cuando se bombardean ciertos núcleos estables con partículas apropiadas. Si la energía de estas partículas tiene un valor adecuado penetran dentro del núcleo bombardeado y forman un nuevo núcleo que, en caso de ser inestable, se desintegra después radiactivamente. Fue descubierta por los esposos Jean Frédéric Joliot-Curie e Irène Joliot-Curie, bombardeando núcleos de boro y aluminio con partículas alfa. Observaron que las sustancias bombardeadas emitían radiaciones después de retirar el cuerpo radiactivo emisor de las partículas de bombardeo.
En 1934 Fermi se encontraba en un experimento bombardeando núcleos de uranio con los neutrones recién descubiertos. En 1938, en Alemania, Lise Meitner, Otto Hahn y Fritz Strassmann verificaron los experimentos de Fermi. Es más, en 1939 demostraron que parte de los productos que aparecían al llevar a cabo estos experimentos era bario. Muy pronto confirmaron que era resultado de la división de los núcleos de uranio: la primera observación experimental de la fisión. En Francia, Jean Frédéric Joliot-Curie descubrió que además del bario, se emitían neutrones secundarios en esa reacción, haciendo factible la reacción en cadena.
También en 1932 Mark Oliphant teorizó sobre la fusión de núcleos ligeros (de hidrógeno), describiendo poco después Hans Bethe el funcionamiento de las estrellas en base a este mecanismo.
El estudio de la radiactividad permitió un mayor conocimiento de la estructura del núcleo atómico y de las partículas subatómicas. Se abre la posibilidad de convertir unos elementos en otros. Incluso el sueño de los alquimistas de transformar otros elementos en oro se hace realidad, aunque no resulte rentable.
Clases y componentes de radiación
Se comprobó que la radiación puede ser de tres clases diferentes:
- Radiación alfa: son flujos de partículas cargadas positivamente compuestas por dos neutrones y dos protones (núcleos de Helio). Son desviadas por campos eléctricos y magnéticos. Son poco penetrantes aunque muy ionizantes. Y son muy energéticos.
- Radiación beta: son flujos de electrones (beta negativas) o positrones (beta positivas) resultantes de la desintegración de los neutrones o protones del núcleo cuando este se encuentra en un estado excitado. Es desviada por campos magnéticos. Es más penetrante aunque su poder de ionización no es tan elevado como el de las partículas alfa. Por lo tanto cuando un átomo expulsa una partícula beta aumenta o disminuye su número atómico una unidad (debido al protón ganado o perdido).
- Radiación gamma: son ondas electromagnéticas. Es el tipo más penetrante de radiación. Al ser ondas electromagnéticas de longitud de onda corta, tienen mayor penetración y se necesitan capas muy gruesas de plomo u hormigón para detenerlos.
Las leyes de desintegración radiactiva, descritas por Soddy y Fajans, son:
- Cuando un átomo radiactivo emite una partícula alfa, la masa del átomo (A) resultante disminuye en 4 unidades y el número atómico (Z) en 2.
- Cuando un átomo radiactivo emite una partícula beta, el número atómico (Z) aumenta o disminuye en una unidad y la masa atómica (A) se mantiene constante.
- Cuando un núcleo excitado emite radiación gamma no varía ni su masa ni su número atómico, solo pierde una cantidad de energía hν (donde "h" es la constante de Planck y "nu" es la frecuencia de la radiación emitida).
Las dos primeras leyes indican que cuando un átomo emite una radiación alfa o beta se transforma en otro átomo de un elemento diferente. Este nuevo elemento puede ser radiactivo, transformándose en otro, y así sucesivamente, dando lugar a las llamadas series radiactivas.
Causa de la radiactividad
En general son radiactivas las sustancias que no presentan un balance correcto entre protones o neutrones, tal como muestra el gráfico al inicio del artículo. Cuando el número de neutrones es excesivo o demasiado pequeño respecto al número de protones se hace más difícil que la fuerza nuclear fuerte debida al efecto del intercambio de piones pueda mantenerlos unidos. Eventualmente el desequilibrio se corrige mediante la liberación del exceso de neutrones o protones, en forma de partículas α que son realmente núcleos de Helio, partículas ß que pueden ser electrones o positrones. Estas emisiones llevan a dos tipos de radiactividad mencionados:
- Radiación α, que aligera los núcleos atómicos en 4 unidades másicas, y cambia el número atómico en dos unidades.
- Radiación ß, que no cambia la masa del núcleo, ya que implica la conversión de un protón en un neutrón o viceversa, y cambia el número atómico en una sola unidad (positiva o negativa, según la partícula emitida sea un electrón o un positrón).
La radiación por su parte se debe a que el núcleo pasa de un estado excitado de mayor energía a otro de menor energía, que puede seguir siendo inestable y dar lugar a la emisión de más radiación de tipo α, β o γ. La radiación γ es por tanto un tipo de radiación electromagnética muy penetrante ya que tiene una alta energía por fotón emitido.